 Présentation
Présentation La plate-forme BIOMADE (
BIOhybrid
MAterial
Design
Engineering), créée dans le cadre de l’action Minatec-Labs de notre institut au bâtiment 10.05 (2
ème étage, pièce 443), a été mise en route à l’automne 2016. Ce laboratoire, soutenu par le CPER, le programme Nanosciences et le projet Phare A3DN, est rattaché au SyMMES/CREAB. Son activité est dédiée à l’ingénierie des acides nucléiques (ADN, ARN, analogues structuraux) et leur insertion au sein d’architectures hybrides 2D/3D après conjugaison avec des molécules organiques, des biomolécules, des polymères ou encore des nano- et microparticules.
 Vue panoramique de la plate-forme BIOMADE
Vue panoramique de la plate-forme BIOMADE Cette plate-forme regroupe au sein d’un espace unique (cf photo) toutes les techniques nécessaires à cette ingénierie biochimique et chimique depuis la synthèse des fragments d’ADN modifiés, leur fonctionnalisation, leur purification et leur auto-assemblage au sein de nanostructures/nanomatériaux hybrides aux applications potentielles en micro- et nanoélectronique, photonique, plasmonique ou encore dans les technologies pour la santé (biocapteurs, agents d’imagerie, vectorisation). A noter que par son implantation géographique, cette activité bénéficie de la proximité des moyens de nano-caractérisations de la PTA et de la PFNC du campus Minatec.
 Appareils disponibles sur la plate-forme
Appareils disponibles sur la plate-forme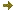 Synthétiseurs d'ADN et d'ARN (et analogues structuraux)
Synthétiseurs d'ADN et d'ARN (et analogues structuraux)
 Cycle de synthèse automatisée par la méthode des phosphoramidites en phase solide.
Cycle de synthèse automatisée par la méthode des phosphoramidites en phase solide.
Synthétiser un fragment d’ADN/ARN (oligonucléotide) consiste à relier des nucléosides entre eux par un groupement phosphate en formant des liens phosphodiesters. Ces nucléosides se composent d’un sucre (désoxyribose pour l’ADN ; ribose pour l’ARN) et d’une base azotée (A pour Adénine, C pour Cytosine, G pour Guanine, T pour Thymine et U pour Uracile). La chimie de couplage utilisée est celle des phosphoramidites qui permet d’obtenir un rendement de condensation élevé. Cette méthode d’assemblage du bioploymère, qui est réalisée sur support et de manière totalement automatisée (voir photo ci-dessus de 2 synthétiseurs), se déroule en 4 étapes : la détritylation, la condensation, le capping et l’oxydation (cycle de synthèse cf schéma).
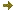 Chromatographie liquide haute performance couplée à un détecteur UV/visible, un détecteur de fluorescence et un détecteur de masse
Chromatographie liquide haute performance couplée à un détecteur UV/visible, un détecteur de fluorescence et un détecteur de masse
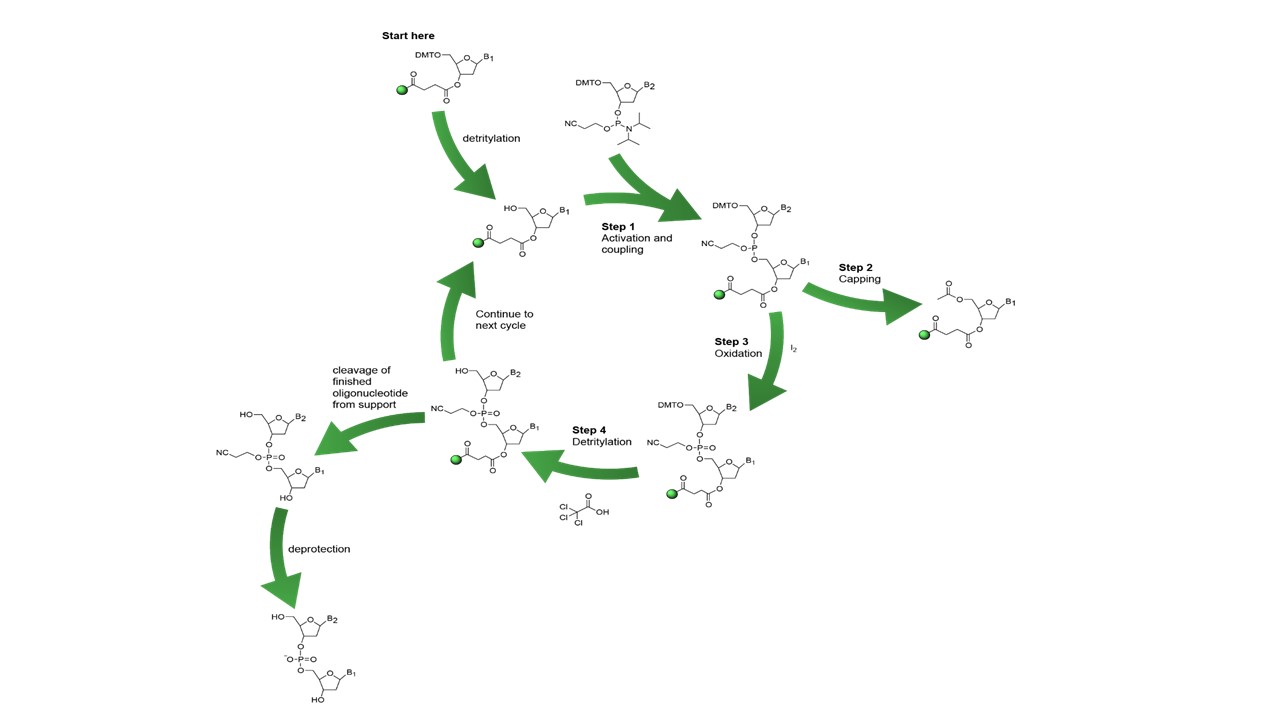
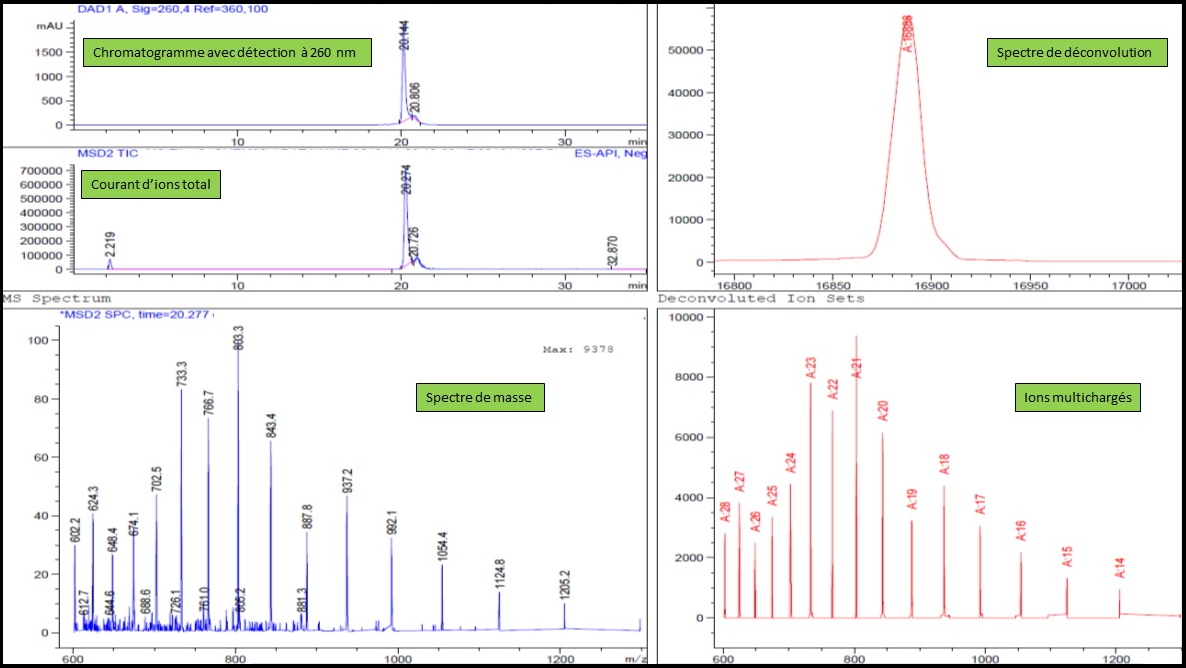 Chromatogramme et spectre de masse d'un fragment d'ADN modifié.
Chromatogramme et spectre de masse d'un fragment d'ADN modifié. Photographie de la chaîne C.L.H.P. équipée de ses différents détecteurs.
Photographie de la chaîne C.L.H.P. équipée de ses différents détecteurs. En fin de synthèse, après déprotection et libération du support, les fragments d’ADN sont séparés sur une chaîne de Chromatographie Liquide Haute Performance (C.L.H.P) et identifiés grâce à un détecteur U.V. / Visible (barrette de diodes), un détecteur de fluorescence et à un détecteur de masse de type ESI-MS (source ELECTROSPRAY). Non couplée au détecteur de masse, cette technique est aussi utilisée pour purifier les oligonucléotides issus d’un mélange brut de synthèse.
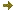 Spectrométrie de masse MALDI-TOF
Spectrométrie de masse MALDI-TOF
 Séquençage enzymatique d'un fragment d'ADN modifié.
Séquençage enzymatique d'un fragment d'ADN modifié.
Le spectromètre de masse MALDI-TOF (Matrix Assisted Laser Desorption ionisation Time of Flight*) est idéal pour l’analyse et la détermination de la masse de molécules de grande taille (isolées ou en mélange) telles que les fragments d’ADN, les protéines, les peptides et polymères. La source MALDI favorise la formation d’ions possédant une seule charge et le temps de vol se caractérise par une gamme de masse infinie.
 Spectromètre U.V./visible
Spectromètre U.V./visible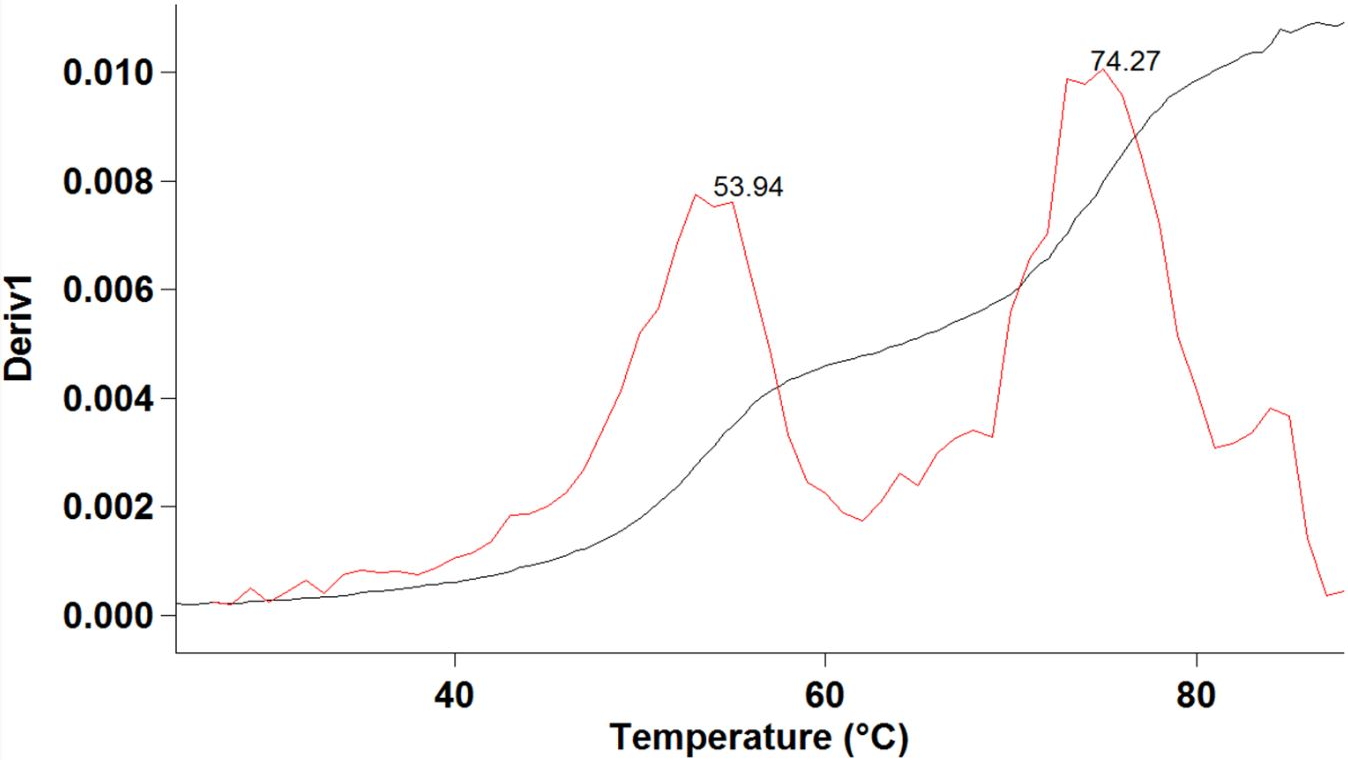 Mesure de température de fusion d'une nanostructure d'ADN.
Mesure de température de fusion d'une nanostructure d'ADN.
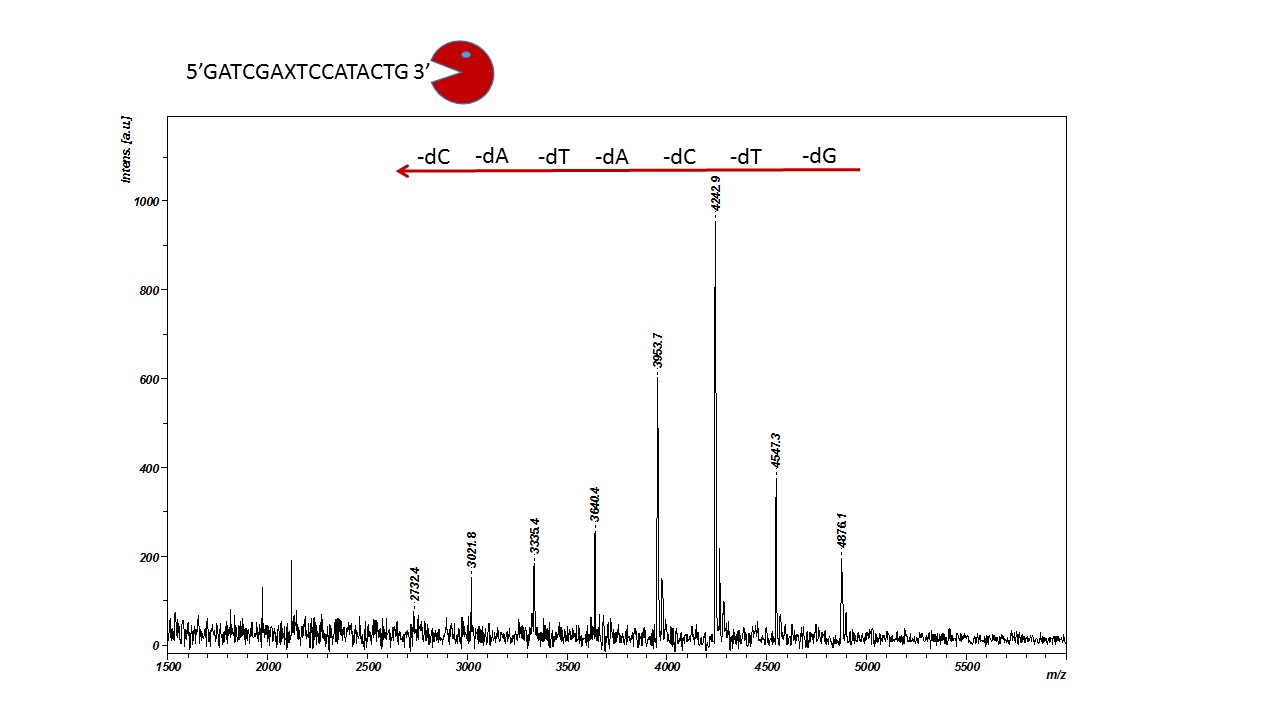
La spectroscopie U.V./VISIBLE est une méthode utilisée en routine pour doser la quantité d’ADN présente en solution sous forme de simple brin ou double brin. Cette quantification est basée sur l’absorbance du biopolymère dans l’U.V. (maximum d’absorbance à 260 nm). De plus, en chauffant une structure en double brin d’ADN on peut obtenir une séparation de l’édifice en deux simples brins. On parle alors de dénaturation thermique (rupture des liaisons Hydrogène existant entre les bases appariées). La température à laquelle la moitié des molécules d’ADN est dénaturée est appelée température de fusion moléculaire.
L’appareil (Agilent Cary 100, photo ci-dessus) présent sur la plate-forme BIOMADE est équipé d’un double faisceau et d’un passeur d’échantillons multi-cuves thermostaté par effet Peltier avec contrôle de la température qui permet de suivre ce processus de dénaturation et de déterminer ainsi cette température de fusion.
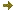 Spectromètre U.V. et spectrofluorimètre en mode micro-goutte
Spectromètre U.V. et spectrofluorimètre en mode micro-goutte
 Spectre U.V d'un oligonucléotide modifié.
Spectre U.V d'un oligonucléotide modifié. Ces deux appareils permettent, à l’aide de quelques microlitres seulement, le dosage de solutions d’ADN/ARN par mesure d’absorbance U.V. (Denovix DS-11) ou par fluorescence après marquage par un chromophore (Nanodrop ND3300).
 Électrophorèse (Gels de polyacrylamide ou d'agarose)
Électrophorèse (Gels de polyacrylamide ou d'agarose)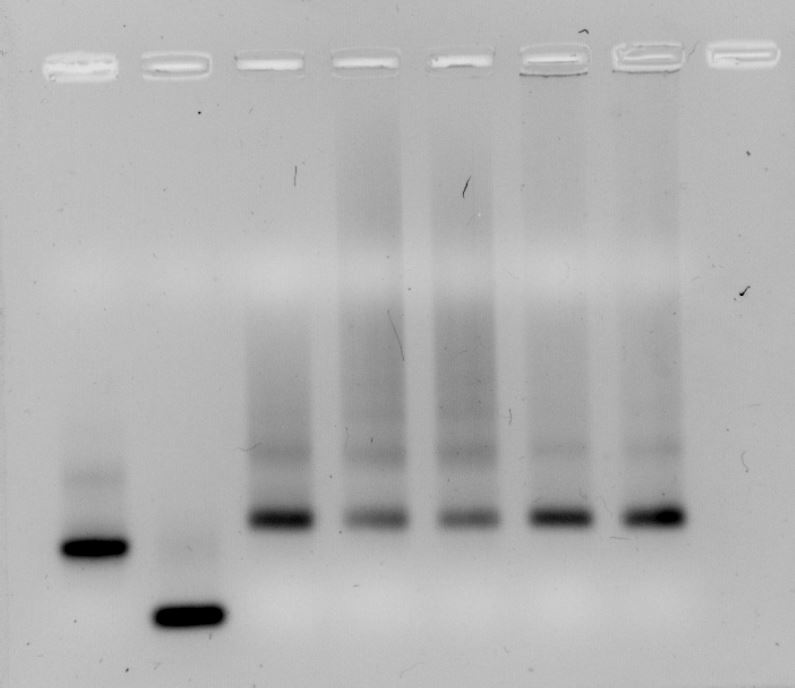 Séparation de nano-objets à base d'ADN sur gel d'agarose.
Séparation de nano-objets à base d'ADN sur gel d'agarose.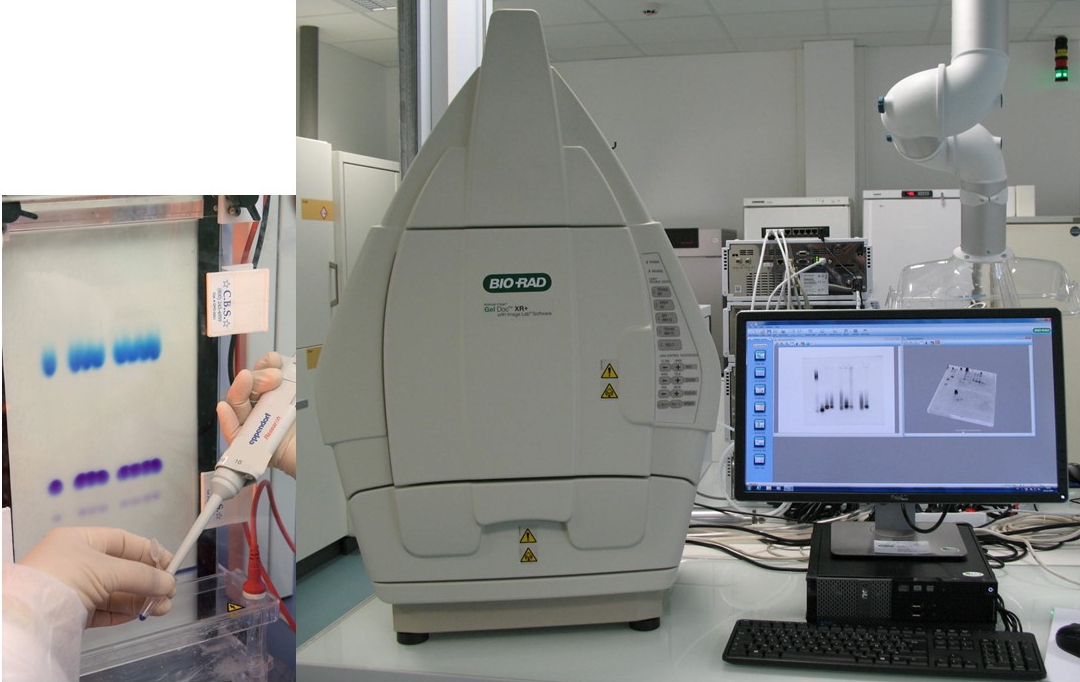 Système d'electrophorèse sur gel d'acrylamide (à gauche) et imageur de gel associé (à droite).
Système d'electrophorèse sur gel d'acrylamide (à gauche) et imageur de gel associé (à droite). L’électrophorèse sur gel, en milieu dénaturant ou non, permet d’analyser les brins d’ADN ou les nano-objets à base d’ADN en fonction de leur taille et de leur charge électrique. Le gel constitué de polymères à base de polyacrylamide ou d’agarose est soumis à une différence de potentiel qui conduit à la séparation des fragments d’ADN /ARN chargés négativement. Cette technique peut être utilisée à l’échelle analytique pour réaliser le contrôle d’un échantillon ou à l’échelle préparative pour faire une purification. Ces gels sont généralement révélés à l’aide d’un intercalant fluorescent (GelRed, SyberGreen, SybrGold…) et numérisés à l’aide d’un imageur de gel (GelDoc BIORAD).
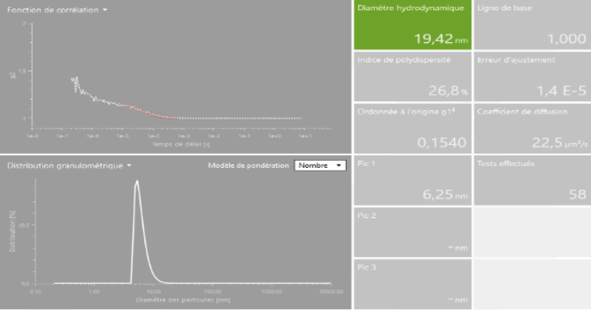
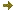 Dynamic lightscattering (DLS) / Zetapotentiel
Dynamic lightscattering (DLS) / Zetapotentiel
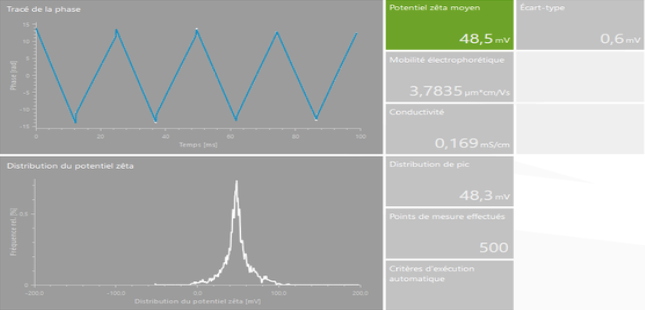
Cet appareil de type « Litesizer 500 » de chez Anton Paar est un système d’analyse couplant la mesure de la taille de nano-objets par Diffusion Dynamique de la Lumière (Dynamic Light Scattering) et la mesure de la Charge de Surface (Potentiel Zêta). Equipé d’un laser (658 nm), il permet l’analyse en solution de nanoparticules, de protéines, d’assemblages protéiques, de nanostructures à base d’acides nucléiques ainsi que de nano-systèmes hybrides.
Mesure de taille de particules | | Mesures de potentiel Zêta |
| | | |
| |
|
 L'équipe CREAB en visite à BIOMADE.
L'équipe CREAB en visite à BIOMADE. ContactsDidier Gasparutto
ContactsDidier Gasparutto tel. : 04 38 78 45 48 ou 66 24
Christine Saint-Pierre tel. :04 38 78 32 65 ou 66 24 (
Biographie)