Le superoxyde O
2•-, espèce réactive de l’oxygène, est un radical libre produit dans les cellules vivantes utilisant le dioxygène. Ce radical peut être toxique pour les organismes vivants en réagissant avec l’
ADN ou en perturbant la production de protéines. Pour détruire le superoxyde, les superoxydes dismutases (SOD) sont des métalloenzymes qui catalysent sa dismutation au niveau de leur site actif à base d’ions métalliques (Fe, Mn, Cu, Zn). Des études récentes s’intéressent à une SOD bactérienne dont le site actif possède un ion nickel, la NiSOD. La compréhension du mécanisme catalytique de la NiSOD et l’optimisation de complexes bio-inspirés de cette enzyme pourraient permettre de concevoir de nouvelles thérapies contre les maladies liées au stress oxydant, comme les maladies inflammatoires chroniques de l’intestin.
La dismutation du superoxyde O
2•- est catalysée par l’enzyme NiSOD dont le site actif est un complexe plan carré de l’ion métallique Ni
II (
Figure 1). Afin d’élucider le mécanisme catalytique de cette enzyme, les chercheurs de notre laboratoire, en collaboration avec le Département de Chimie Moléculaire de l’UGA, mettent au point des complexes inspirés du centre actif de la NiSOD, en variant la coordination des atomes d’azote et de soufre autour de l’ion Ni
II. Ainsi, un tripeptide dérivé du motif ATCUN (
Amino Terminal CuII and NiII binding motif) permet ainsi de reproduire la coordination N
3S
1 de l’ion métallique dans une géométrie plan carré (
Figure 2). Les résultats, dans les conditions physiologiques (eau, pH 7), montrent une activité catalytique de ce complexe de type SOD. En dépit de leur courte durée de vie et de leur faible concentration, les chercheurs sont parvenus à identifier en solvant organique et à basse température, deux intermédiaires réactionnels instables : les complexes superoxo Ni
II, et hydroperoxo Ni
III qui présente une interaction directe du superoxyde avec l’ion métallique (
Figure 2). Les deux complexes ont été caractérisés expérimentalement par Résonance Paramagnétique Electronique et par spectroélectrochimie. Leurs signatures concordent avec les calculs obtenus par DTF (Théorie de la Fonctionnelle de la Densité).
Ces complexes bio-inspirés constituent des structures variées qui ont l’avantage d’être stables dans l'eau et dans les solvants organiques et permettent de mieux comprendre les mécanismes de dismutation du superoxyde par l’enzyme NiSOD. À l’avenir, les chercheurs optimiseront ces complexes en espérant développer des nouvelles molécules afin de lutter contre les effets nocifs du stress oxydant.
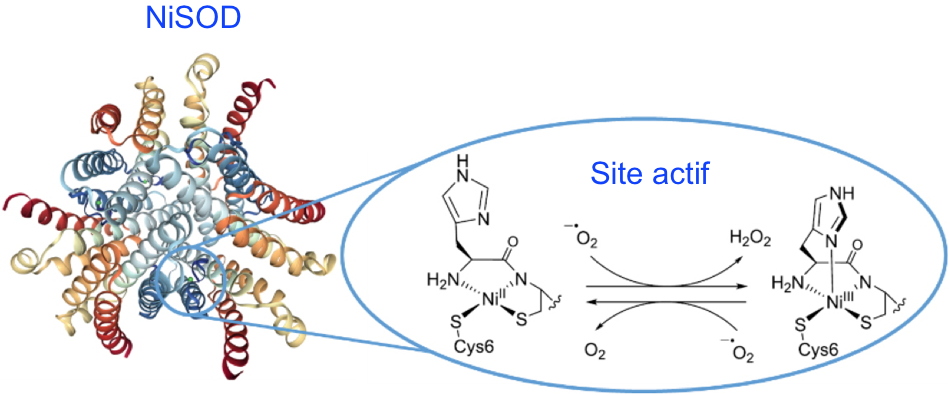
Figure 1 : Au cœur du site actif de la superoxyde dismutase NiSOD (
pdb 1T6U), le centre Ni
II forme un plan carré coordonné à deux fonctions thiolates de cystéinates, à l'amine terminale de la chaîne peptidique, et à une fonction amidate d'une liaison peptidique. L'état Ni
III formé au cours de la dismutation présente une géométrie de type pyramide à base carrée due à la liaison supplémentaire de l'imidazole de l'histidine en position axiale.
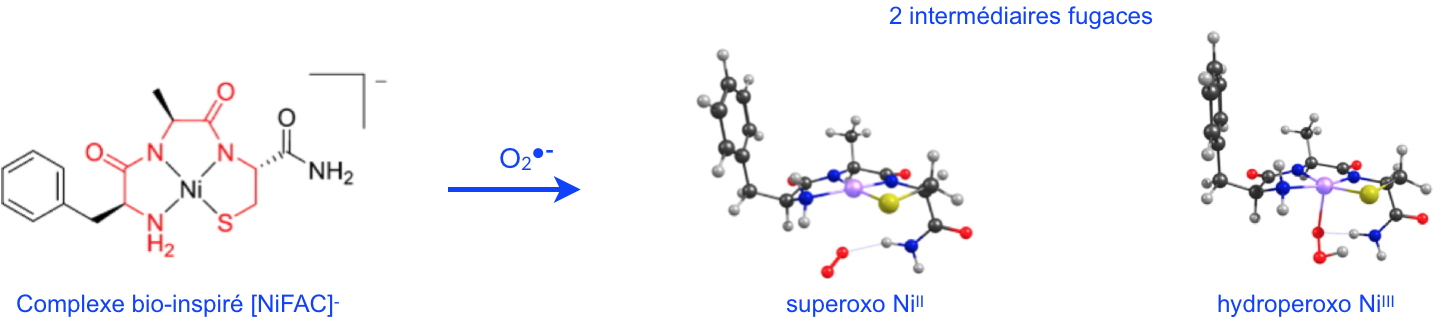
Figure 2 : Lors de la réaction avec le superoxyde, le complexe bio-inspiré de la NiSOD, [NiFAC]
- permet de révéler deux intermédiaires réactionnels fugaces :
1) le complexe superoxo Ni
II implique une liaison de O
2•-via un groupe NH
2 terminal ;
2) le complexe hydroperoxo Ni
III montre l’interaction directe de O
2•- avec l’ion nickel.
Les structures sont optimisées par DFT : C (noir), H (gris), O (rouge), N (bleu), S (jaune), Ni (violet).
Projet financé par l’EUR-CBH (Graduate School of Chemistry, Biology and Health).