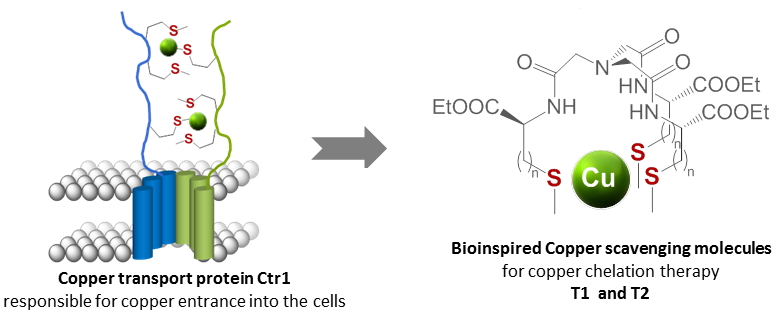
Le cuivre est vital mais aussi toxique pour la vie. Il joue un rôle essentiel dans un certain nombre de processus vitaux, mais des concentrations élevées de cuivre peuvent être nocives et entraîner des dommages oxydatifs. Les protéines impliquées dans la régulation du Cu sont une source d'inspiration fascinante dans la conception de molécules piégeant le Cu pour la thérapie de chélation du cuivre. Parmi eux, la protéine de transport du Cu(I) Ctr1 est essentielle pour l'entrée du cuivre dans les cellules. Elle lie le Cu(I) grâce à trois atomes de soufre provenant de trois résidus méthionine.
Pour imiter cette protéine, des architectures moléculaires ont été synthétisées à partir d'un échafaudage d'acide nitrilotriacétique fonctionnalisé avec trois acides aminés portant des chaînes latérales thioéther, soit la méthyl cystéine en T1 ou la méthionine en T2. Ces deux ligands T1 et T2 ont été obtenus avec de bons rendements globaux et démontrent une capacité de chélation efficace pour Cu(I). Dans chaque cas, un seul complexe mononucléaire, [CuT1,2]+ a été mis en évidence par ionisation électrospray-spectrométrie de masse (ESI-MS) et la signature de dichroïsme circulaire a montré une réorganisation de l'échafaudage pseudo-peptidique lors de la complexation de Cu(I). Considérant que les fonctions thioéther sont des donneurs de soufre neutres, les constantes de stabilité sont assez grandes et significativement plus élevées (logK ~ 10) que celles évaluées pour les modèles peptidiques Ctr1 (logK ~ 5). Ce comportement peut être attribué à une organisation optimale des sites de fixation du soufre autour de l'ion cuivre grâce à l'échafaudage chimique.
Ces chélateurs de Cu(I) sont intéressants pour des applications dans la thérapie de chélation pour le traitement de maladies liées à une surcharge en Cu, comme la maladie rare de Wilson. En plus de leurs propriétés optimales de piégeage du Cu(I), ces ligands ne sont pas sensibles à un environnement oxydant extracellulaire. En outre, le Cu est également connu pour être impliqué dans plusieurs maladies neurodégénératives telles que la maladie d'Alzheimer et les voies du Cu sont utilisées pour amener des médicaments anticancéreux comme le cisplatine à leur cible. Par conséquent, le développement de tels chélateurs Cu est d'un grand intérêt pour de nombreuses applications médicales.
Ce projet de recherche a été financé par l'ANR émergence, la Fondation pour la Recherche Médicale et le labex ARCANE « Chimie Biomotivée ».